
技术文章
 更新时间:2025-08-25
更新时间:2025-08-25 点击次数:416
点击次数:416

L-乳酸被认为是信号传导和代谢平衡的关键分子。乳酰化,一种由L-乳酸衍生的蛋白质翻译后修饰(PTM),在多种蛋白质上普遍存在,并在细胞过程中发挥重要作用。25年6月由浙江大学张龙教授团队发表在《STAR Protocol》上的《Protocol for label-free quantitative lysine lactylproteome profiling》介绍了一种全面分析乳酰化蛋白质组并进行无标签定量的方法。作者详细介绍了细胞制备、蛋白质提取、消化、肽脱盐及乳酰肽富集的步骤。此外,还概述了液相色谱-串联质谱(LC-MS/MS)分析的参数设置。
方案概览:
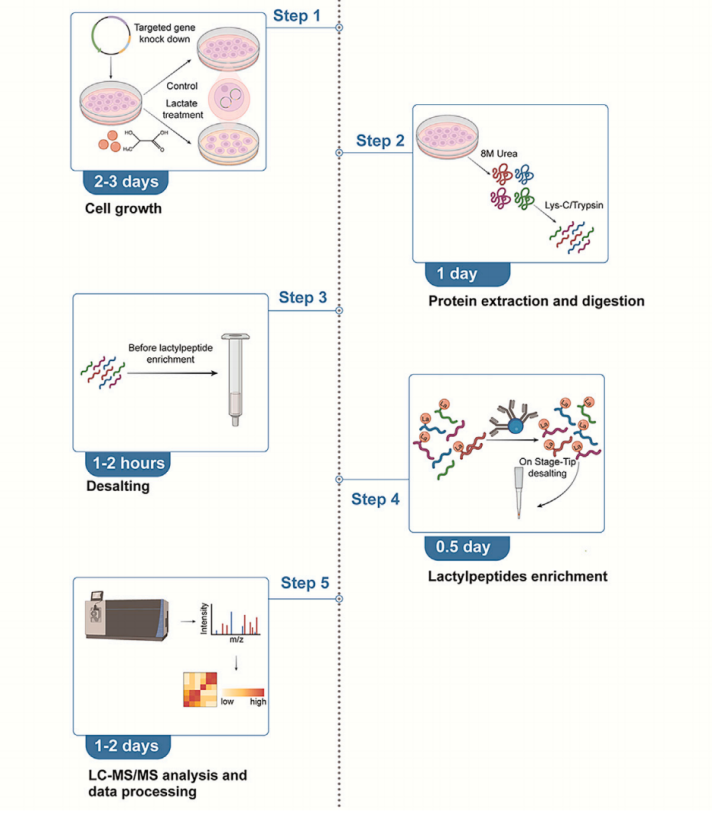
准备工作:
该方案描述了在AARS1和AARS2(AARS1/2)敲低、过表达以及野生型细胞中进行乳酸化分析的定量方法。
实验时需准备以下材料:
编码AARS1/2的哺乳动物细胞表达载体及针对AARS1/2的siRNA
在含有10%(体积比)胎牛血清、100 mg/mL青霉素和链霉素的DMEM培养基中培养HEK293T细胞和HeLa细胞
将细胞系置于37C、5%二氧化碳的湿润培养箱中培养。定期检测是否有支原体细胞污染
至少每48小时更换一次细胞培养基,吸出一半旧培养基(注意不要破坏细胞spheroids结构),并补充等量的新鲜培养基
校准LC-MS设备,并运行质量控制样本,如HeLa细胞裂解物标准品,以确保LC-MS/MS性能符合预期
分步方法详解
细胞培养
时间:2天
本部分介绍了用于转染的 HEK293T 细胞培养物的制备
37℃水浴中预热 DMEM、PBS 和胰蛋白酶-EDT
使用10 cm 培养皿培养 HEK293T 细胞,在培养条件为5% CO2和 37℃,使用DMEM 培养基培养直至达到 80%–90% 细胞密度
吸出生长培养基并用 2 mL 无菌 PBS 轻轻清洗细胞两次
吸出 PBS,加入 1 mL 胰蛋白酶-EDTA 分离细胞,37℃孵育直至细胞分离(约 30 秒
为了中和胰蛋白酶-EDTA,添加 2 mL 生长培养基并通过移液重新悬浮,直到所有细胞从培养皿底部剥离
将细胞悬浮液转移到 15 mL Falcon 管中,在 22℃–25℃之间以 200 xg 离心 3 分钟,使细胞沉淀
吸出上清液并将细胞沉淀物重悬在 1 mL 新鲜生长培养基中
将四分之一的细胞悬浮液接种到一个新的 10 厘米培养皿中,并添加额外的8 毫升新鲜生长培养基
培养细胞直至其达到转染所需的最佳细胞密度
细胞转染
时间:60-120分钟
将AARS1/2 siRNA、AARS1/2质粒或对照质粒单独或组合转染至HEK293T细胞中。每次处理应至少准备两个10 cm细胞培养皿,以提供足够的蛋白质用于乳酰肽的富集。在本方案中,我们使用聚乙烯亚胺(PEI)转染AARS1/2构建体或对照质粒,并使用脂质体转染siRNA。转染所需的siRNA、DNA构建体和转染试剂用量见下面。
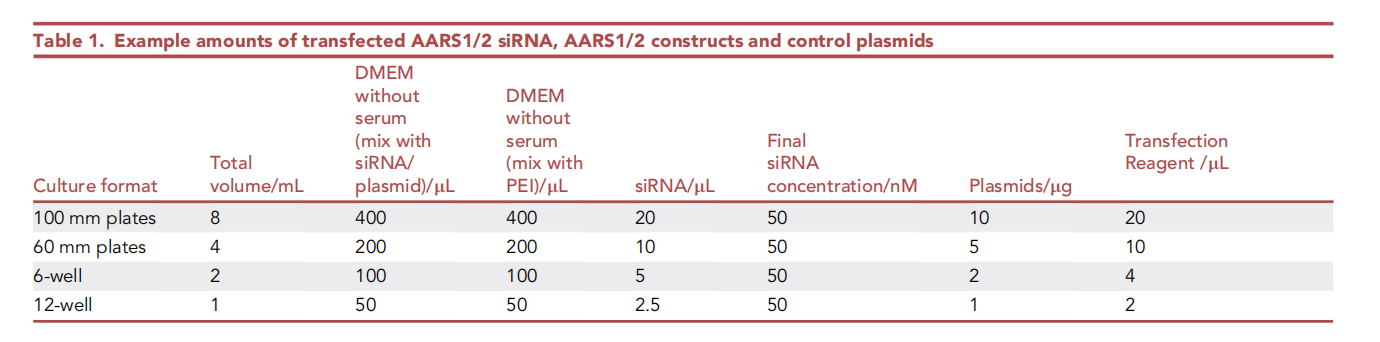
10、转染前培养细胞直至其达到 40%–50% 细胞密度
11、使用不含血清的 DMEM 培养基稀释表中所示适量的 siRNA 或质粒
注意:siRNA 应悬浮于无 RNase 的水中,并以 20–100 mM 的浓度储存
使用无血清的 DMEM 培养基,按照表中所示稀释适量的脂质体转染试剂或PEI,将其与稀释的 siRNA 或质粒混合,室温孵育 20 分钟
将DNA混合物逐滴加入相应的培养皿中
将转染后的细胞置于37℃、5%二氧化碳的培养箱中孵育6小时
吸出培养基,更换为新鲜的DMEM培养基
注意:在所有siRNA实验中,必须设置对照组以评估靶向基因敲低的效果
乳酸刺激
时间:1天
为了更全面地比较不同实验中蛋白质乳酸化水平的变化,除了常规培养的细胞外,我们还建立了一个平行组,在该组中,乳酸被添加到细胞培养基中,以提高乳酸化的水平。
更换为新鲜的DMEM培养基后,将乳酸溶液以25 mM的最终浓度加入培养基中
在培养箱中继续孵育细胞24-36小时
细胞收获和裂解
耗时:2小时
小心地从细胞中吸出培养基
每次添加 2 mL 冰冷 PBS 冲洗细胞两次
加入 1 mL PBS 并吹打直至所有细胞脱离培养皿底部,从而分离细胞。将细胞收集到新的 1.5 mL Eppendorf 管中
注意:如果细胞粘附过度,无法通过移液器将其从培养皿底部取下,请使用细胞刮刀将细胞分离
在 4℃ ,900 x g 离心 10 分钟,沉淀细胞
吸出上清液。
注意:如果您计划进行 SILAC 实验,请在此步骤中计数细胞并混合等量的重同位素标记细胞和对照细胞
用 500 mL denaturing lysis buffer重悬细胞沉淀
使用ultrasonic Horn进行超声处理以降低细胞裂解物粘度(共 2 分钟;脉冲模式:开启 2 秒,关闭 2 秒;幅度设置为 35%)
注意:
应根据蛋白质的量和蛋白质溶液的体积来选择超声的尺寸和超声波处理的持续时间
使用冰浴以防止超声处理过程中蛋白质降解
将样品在 4°C 下以 13000 x g 的速度离心 15 分钟,以去除不溶性物质。将上清液收集到一个新的 1.5 mL Eppendorf 管中
蛋白质消化
耗时:0.5天
使用 BCA 分析法确定细胞裂解物的蛋白质浓度,并分离 2 mg 蛋白质进行消化
注意:BCA 检测的标准曲线应覆盖样品预期浓度的整个范围。每次检测样品都需要建立标准曲线
27.沉淀蛋白质
A、用 100 mM Tris-HCl、pH 8.5 将裂解物溶液稀释至 4 M 尿素
关键:浓度为 8 M 时,添加丙酮后尿素会沉淀出来,影响蛋白质的消化效率
B、将冰冷的丙酮添加到裂解物溶液中,并在 -20℃ 下孵育混合物 30 分钟,使用体积为裂解物溶液六倍
C、在 4℃ 下以 13000 x g 离心 30 分钟,使沉淀的蛋白质沉淀下来。
暂停点:样品可以在-80℃的温度下在此点保存长达1个月
28.用 Lys-C 消化
A、用 500 μL 50 mM ABC 缓冲液重新悬浮蛋白质沉淀
注意:50 mM ABC 缓冲液的 pH 应为 8.0。如果 pH 值偏差过大,请准备新的缓冲液
B、将 Lys-C 添加到裂解物中,最终浓度为 10 ng/μL
C、 37℃ 下孵育 3-4 小时。
关键:将蛋白质颗粒悬浮在转速设为 1500 rpm 的培养摇床上
29.用胰蛋白酶消化
A、以 1:100 的酶与底物比例将胰蛋白酶添加到反应混合物中
B、在 37℃ 下孵育 12 小时
30.肽还原和烷基化
A、将 5 μL 1 M TCEP 缓冲液加入蛋白消化液中,充分混匀,25℃ 孵育 15 分钟
B、将 10 μL 500 mM IAA 缓冲液加入蛋白消化液中。混匀,25℃避光孵育 20 分钟
关键:IAA 对光不稳定,烷基化应在黑暗中进行。
通过添加 TFA 至最终浓度为 1% 来终止消化
在室温下以 13000 x g 的速度离心样品 5 分钟,以去除不溶性物质
将上清液转移到新的 5 mL Eppendorf 管中进行肽脱盐
肽脱盐
耗时:0.5天
文中使用reverse-phase Strata-X 33 mm Polymeric sorbent solid-phase extraction cartridges 柱体尺寸的选择应基于消化蛋白的量,约为填料重量的 10% (wt/wt)。
34.用 1 mL 脱盐活化缓冲液cartridges
关键:洗脱步骤前请勿排空滤芯。每个步骤结束时,滤芯上方应保留一层液体。
35.使用 2 mL SPE 平衡缓冲液平衡cartridges
36.装入收集的肽溶液。
注意:样品通过后,catridges可能会变黄,这表明已经进行了还原和烷基化。
37.用 2 mL SPE 平衡缓冲液清洗。
38.用 1 mL SPE 洗脱缓冲液洗脱,并将洗脱液收集到新的 1.5 mL Eppendorf 管中
39.分离 50 μL 洗脱液(100 μg 细胞裂解液肽)并用离心机干燥
注意:分离的肽将用于蛋白质组分析
40.用液氮冷冻洗脱液,然后将其冻干
关键:
冻干,并去除样品中的所有残留酸,以便进行下一步的乳肽富集步骤
冻干粉应呈黄白色蓬松状。如果无法冻干,请使用 SpeedVac 离心机干燥洗脱液
暂停点:样品可以在-80℃的温度下在此点保存长达1个月
乳酸化肽段富集
耗时:0.25天
使用抗L-乳酰赖氨酸抗体偶联琼脂糖珠(可使用斯达特Anti-L-lactyllysine agarose Beads替代,货号:S0F0003,用量可根据说明书及样本情况进行调节)。珠子的用量应根据消化的蛋白质量确定。在本方案中,每2 mg蛋白质消化物建议使用10 μL抗L-乳酰赖氨酸抗体偶联琼脂糖珠(图1)。在每个步骤中,使用微量离心机在4℃下以1000 x g离心1分钟,使珠子沉淀
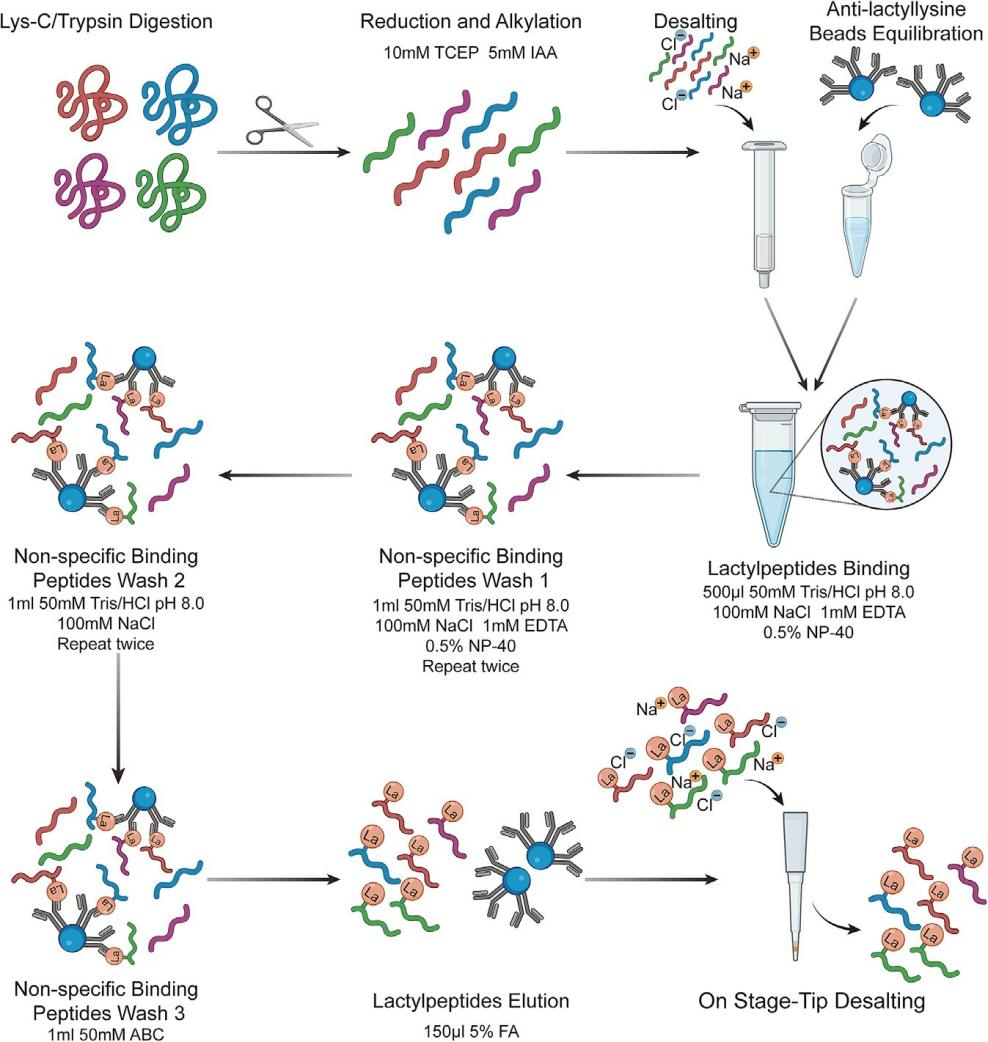
图 1 利用 Anti-L-lactyllysine agarose Beads富集乳酰肽的示意图
注意:在正式实验前,研究人员应应用HeLa细胞裂解物等标准品进行预实验,确保抗L-乳酰赖氨酸抗体偶联琼脂糖珠的富集效率在不同批次和供应商之间保持一致
41.将冻干肽重悬于1 mL乳酰肽binding buffer中。涡旋或超声处理是确保肽溶解的必要措施
注意:在肽富集之前检查溶液的pH值。pH值应约为8.0
在 4℃ 下以 13000 x g 离心 10 分钟,使溶液澄清
吸取10 μL Anti-L-lactyllysine agarose Beads,用1 mL乳酰肽binding buffer清洗微珠。离心使微珠沉淀
将澄清的肽溶液转移到含有Anti-L-lactyllysine agarose Beads的管中,并在 4℃ 下旋转孵育 4 小时
注意:为确保乳酸化肽的富集效率,孵育时间应不少于4小时。不建议过夜孵育,因为过夜孵育会导致更多的非特异性结合
45.通过离心将Beads沉淀下来
注意:收集上清液作为备用,以防乳肽富集失败。上清液可在-80℃保存长达1个月
46.用 1 mL lactylpeptide binding buffer在 4℃ 下旋转清洗珠子两次,每次 10 分钟
47.用 1 mL lactylpeptide wash buffer 4℃下旋转洗涤珠子两次,每次 10 分钟
48.在 4℃ 下旋转,用 1 mL 50 mM ammonium bicarbonate buffer进行最后清洗 10 分钟
49.从珠子中洗脱乳酸化肽段
用 100 μL 1% TFA 重悬珠子,室温放置 10 分钟。离心使珠子沉淀,将上清液收集到新的 1.5 mL Eppendorf 管中
用 50 μL 1% TFA 重悬珠子,旋转孵育 10 分钟。离心使珠子沉淀,将上清液与第一次洗脱液合并。
注意:可使用 0.22 mm 过滤器过滤溶液以去除残留珠子
Stage-tip 脱盐
时间:2 小时
乳酰肽洗脱液需要使用 C18 Stage-tip 进行净化,以进行质谱分析。在本方案中,我们采用 Empore C18 固相萃取盘 (2215-C18) 来进行Stage-tip。
注意:应根据您的阶段吸头调整离心速度,并确保溶剂流速保持在 5 μL /min
用 20 μL 脱盐活化缓冲液调节Stage-tip
用 20 μL Stage-tip脱盐缓冲液 B 清洗阶段吸头
用 20 μL Stage-tip脱盐缓冲液 A 平衡阶段吸头
使乳酸化肽洗脱液通过Stage-tip
用 20 μL Stage tip 脱盐缓冲液 A 对样品进行脱盐
将 Stage-tip 转移至新的 Eppendorf 管中
用 20 μL Stage-tip 脱盐缓冲液 C 洗脱肽。收集流穿液
用 20 μL Stage-tip 脱盐缓冲液 B 洗脱肽。将流穿液与第一次洗脱的流穿液合并
在 SpeedVac 离心机中干燥洗脱液
暂停点:此时样品可在 -80℃ 下保存长达 1 周
LC-MS 分析
时间:数周
作者描述了 Orbitrap Exploris 480 与 Easy-nLC 1200 系统的联用设置
59.准备 LC-MS/MS 设备
A、安装足量的新鲜流动相溶剂 A 和溶剂 B。需要对溶剂 A 和 B 进行超声处理以清除气泡
B、用流动相缓冲液冲洗泵 A、泵 B 和泵 S 中的空气。冲洗阈值为 10 μL
C、用 10 μL 的 90% 溶剂 B 缓冲液激活分析柱
D、通过运行空白样品平衡分析柱。确保流动相流路顺畅
注意:安装流动相溶剂、冲洗空气和激活分析柱可能需要 1小时。运行空白样品可能需要 30 分钟
60.制备 Klac 富集样品
A、将富集的 Klac 肽溶解于 5 μL 0.1% 甲酸(溶剂 A)中
B、 4oC 下以 12,000x g 离心 20 分钟以去除不溶性物质。
C、将 4.5 μL 上清液转移到自动进样器小瓶中
D、将 4 μL 样品装入 Easy-nLC 1200 HPLC
制备蛋白质组样品。
A、用 20 μL 0.1% 甲酸(溶剂 A)溶解步骤 39 中分离的肽
B、在 4oC 下以 12,000x g 离心 20 分钟以去除不溶性物质
C、将 18 μL 上清液转移到自动进样器小瓶中
D、将 1 μL 样品装入 Easy-nLC 1200 HPLC 中
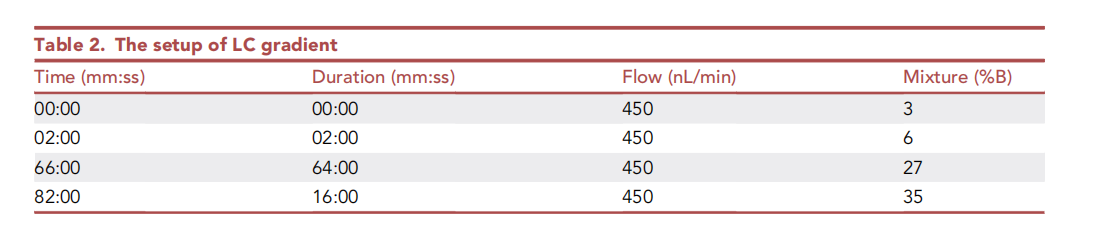
LC 梯度设置如下图所示
63、MS 参数
使用以下参数设置 Orbitrap Exploris 480 的质谱方法
A、正离子模式
B、喷雾电压为 2.0 kV
注意:如果Steel emitter有污渍或磨损,导致喷雾不稳定,请将喷雾电压增加到 2.1 kV
加热毛细管温度为 320oC
将全 MS 分辨率设置为 60,000,最大注射时间为 25ms
将 MS1 质量范围设置为 350–1400,AGC 目标设置为 1e6
使用 Top20 方法将 HCD 碎片谱图分辨率设置为 15,000,最大进样时间为 22 毫秒
将 MS2 质量范围设置为 200–1400 m/z,AGC 目标设置为 5e4
将最大进样时间为 45 ms
将隔离窗口设置为 6 m/z,标准化碰撞能量设置为 27%。
数据处理
时间:0.5 天
概述了使用 MaxQuant 处理原始文件的方法。我们提供了设置新修改的详细步骤以及无标记定量的参数。在本方案中,作者使用 MaxQuant(版本 2.0.3.0),并在 UniProtKB 人类完整蛋白质组序列数据库中搜索所有获取的原始文件。请参阅图 2,了解 MaxQuant 用于分析这些数据的详细参数工作流程。其他软件,例如 Proteome Discoverer、pQuant 和 MSFragger,也可用于处理质谱原始文件和进行非标记定量分析。
注意:赖氨酸的乳酸化会阻止胰蛋白酶消化赖氨酸 C 端。因此,我们建议在“乳酸化 (K)"中选择“非 C 端"。
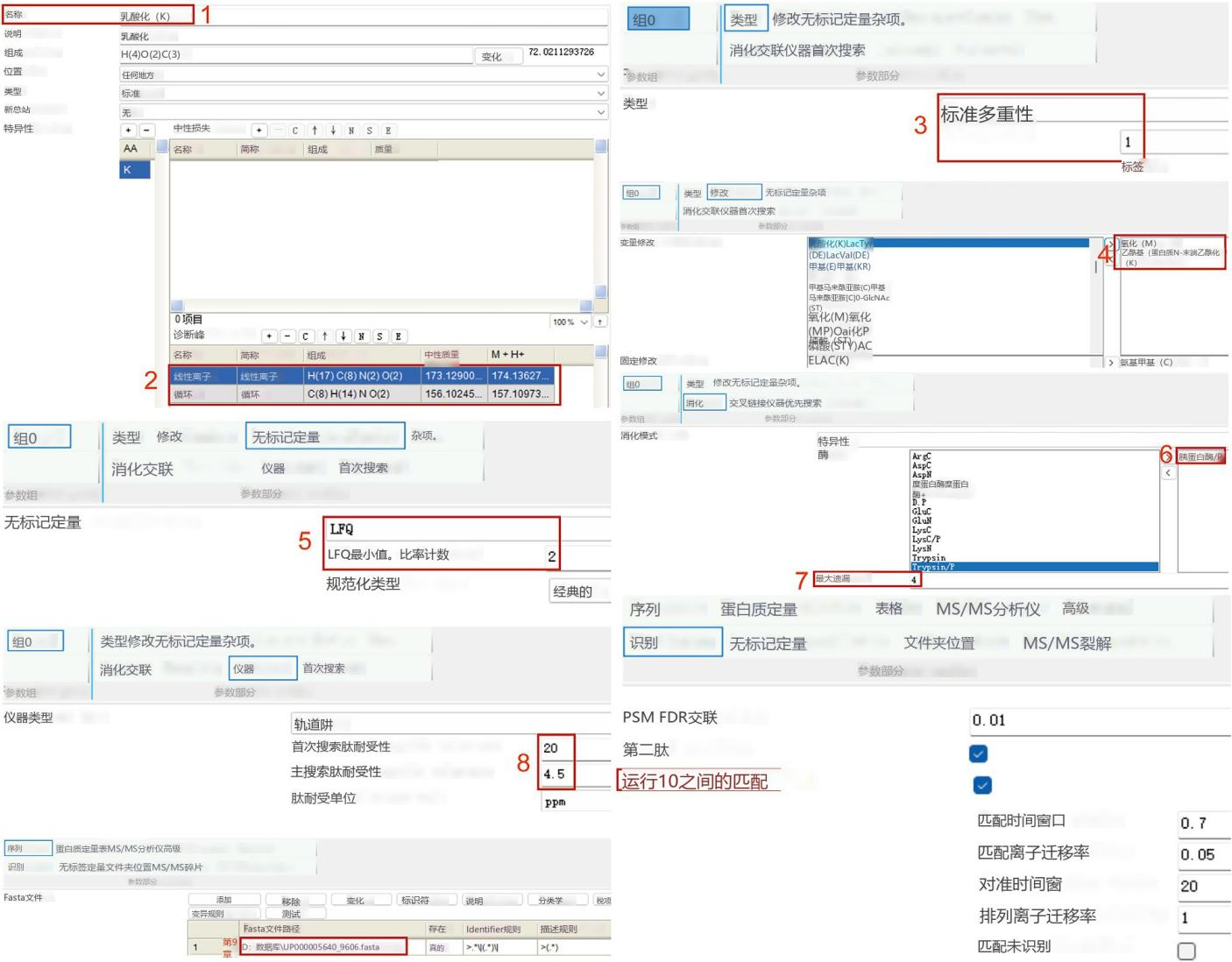
图 2 配置 MaxQuant 参数以鉴定和定量乳酰肽
预期结果
在本方案中,作者执行了一个工作流程来高效富集乳酰赖氨酸肽。基于质谱分析,可以全面分析乳酰赖氨酸修饰,并量化对照细胞、AARS1/2 敲低细胞和 AARS1/2 过表达细胞中的修饰水平。下表显示了使用本方案中描述的工作流程在指定细胞中鉴定出的乳酰赖氨酸修饰位点数量。此外,图 3 和图 4 展示了热图,描绘了各组乳酰赖氨酸修饰的差异。


图 3 热图显示对照、AARS1 和/或 AARS2 耗尽 (si-AARS1/si-AARS2) HEK293T 细胞中整体赖氨酸乳酸组的颜色编码强度水平,用 PBS (Lac ''-'') 或 L-乳酸 (Lac ''+'') 处理 24 小时

图 4. 热图显示了在用对照(AARS1-/AARS2 -)或 AARS1/AARS2 表达质粒(AARS1 +/ AARS2 +)转染的 HeLa 细胞中,整体赖氨酸乳酰化的颜色编码强度水平
斯达特乳酸化相关抗体
杭州斯达特 志在为全球生命科学行业提供优质的抗体、蛋白、试剂盒等产品及研发服务。依托多个开发平台:重组兔单抗、重组鼠单抗、快速鼠单抗、重组蛋白开发平台(E.coli,CHO,HEK293,InsectCells),已正式通过欧盟98/79/EC认证、ISO9001认证、ISO13485。
Cell Star Protocol 重磅解析: 无标签定量赖氨酸乳酸化蛋白组分析方案