
技术文章
 更新时间:2025-12-31
更新时间:2025-12-31 点击次数:218
点击次数:218
在癌症免疫治疗领域,T细胞衔接器(T Cell Engager, TCE)已成为继免疫检查点抑制剂之后的又一革命性支柱。其核心在于巧妙地利用T细胞表面的CD3复合物,将其从基础免疫学概念转化为强大的治疗工具。
一、CD3:从信号枢纽到治疗靶标
CD3复合物(由γε、δε和ζζ二聚体组成)是T细胞受体(TCR)的信号传导模块。其胞内区的免疫受体酪氨酸激活基序是T细胞活化的"启动按钮"。这种与T细胞抗原特异性无关的、普适性的激活能力,使其成为TCE药物设计的理想锚定点。TCE分子通过双特异性结构,强制将T细胞(通过CD3)与肿瘤细胞(通过肿瘤相关抗原)拉近,形成免疫突触,从而绕过MHC限制,直接激活T细胞杀伤功能。
二、临床里程碑:已上市产品的演进与启示
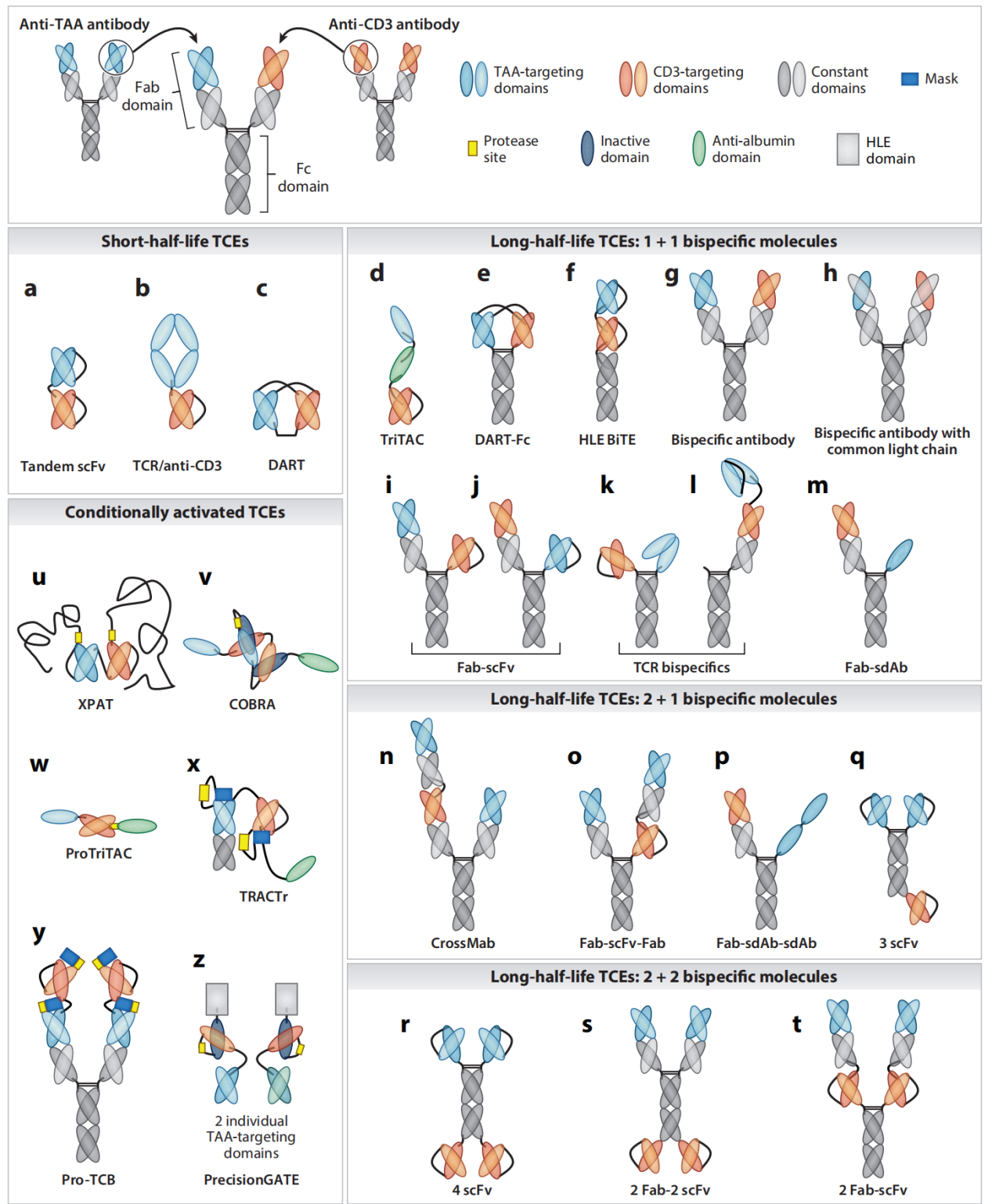
目前,已有十余款TCE药物获批上市,它们清晰地展现了该领域的发展轨迹:
1. 血液肿瘤的突破先锋:
Blinatumomab(Blincyto®):CD3双抗(靶向CD19),用于治疗复发/难治性B细胞急性淋巴细胞白血病。其短半衰期需持续静脉输注,但证明了TCE概念的临床可行性。
新一代血液瘤TCE:Teclistamab(靶向BCMA)、Talquetamab(靶向GPRC5D)、Elranatamab(靶向BCMA)等均已获批用于多发性骨髓瘤。它们采用皮下注射,便利性大幅提升,并优化了CD3亲和力以改善安全性。
2. 攻坚实体瘤的曙光:
Tebentafusp(Kimmtrak®):具有里程碑意义的实体瘤TCE(也是TCR样双特异性免疫疗法),用于治疗HLA-A02:01阳性、葡萄膜黑色素瘤。它一端靶向CD3,另一端使用TCR结构域靶向gp100肽-HLA复合物,为难以治疗的实体瘤开辟了新路。
Tarlatamab(Imdelltra®):2024年获FDA加速批准,用于治疗晚期小细胞肺癌(靶向DLL3)。其显著疗效证实了TCE在侵袭性实体瘤中的巨大潜力,成为行业关注的焦点。
三、前沿进展:创新策略应对核心挑战
为克服细胞因子释放综合征、神经毒性、靶点异质性与肿瘤微环境抑制等挑战,研究围绕CD3工程化展开了多维创新:
1. "亲和力 tuning" 2.0 与条件性激活:
在降低CD3端亲和力的基础上,新一代设计追求 "肿瘤微环境选择性激活" 。例如,设计pH敏感型或蛋白酶激活型TCE,使其仅在酸性的肿瘤微环境或被肿瘤特异性蛋白酶切割后才激活,减少外周毒性。
逻辑门控TCE:开发三特异性或更复杂的分子,要求同时结合两个肿瘤抗原(如EGFR和c-MET)才能有效激活T细胞,极大提高了肿瘤靶向特异性,有望应用于抗原表达异质性的实体瘤。
2. 分子形式与功能拓展:
双抗-ADC偶联物:将TCE与抗体偶联药物结合,在重定向T细胞的同时,直接递送细胞毒性载荷,实现协同杀伤。
集成共刺激信号:在三特异性抗体中引入CD28或4-1BB的共刺激结构域,不仅激活T细胞,还提供第二信号,促进T细胞持久性和记忆形成,克服肿瘤微环境导致的T细胞耗竭。
通用型"模块化"TCE平台:设计一种固定CD3端的分子,其肿瘤靶向端可通过非共价键快速更换,实现针对不同靶点的快速管线开发。
3. 超越肿瘤:新兴治疗领域:
清除纤维化细胞:临床前研究显示,靶向成纤维细胞活化蛋白的TCE能有效逆转肺和肝纤维化。
靶向HIV潜伏库:设计同时结合CD3和HIV包膜蛋白的双特异性抗体,旨在清除病毒潜伏感染的细胞。
结语
从血液肿瘤到实体瘤,从癌症到纤维化疾病,CD3靶向的TCE疗法正以的速度拓展其疆界。对CD3生物学的深刻理解与巧妙的蛋白质工程相结合,已催生出多款挽救生命的药物。未来,随着对T细胞激活逻辑的更精细解码和智能化分子设计的进步,下一代TCE药物将更加精准、安全与强大。CD3,这个T细胞上的古老"开关",正在人类智慧的编程下,指挥着免疫系统向最顽固的疾病发起一场精准而高效的革命。这场革命不仅重新定义了治疗模式,更深刻体现了从基础生物学到转化医学的非凡力量。
CD3蛋白:TCE药物开发的核心引擎
优爱蛋白(UA Bio),重组蛋白专家
优爱蛋白专注于提供药物研发、细胞治疗、基因治疗、基础科研所需各种蛋白类试剂原材料和服务,包括药物靶点蛋白、免疫检查点蛋白、细胞因子、工具酶、 蛋白定制表达、全长跨膜蛋白开发等。优爱致力于为客户提供优质的产品和专业服务,打造具有国际竞争力的企业。