
技术文章
 更新时间:2025-08-26
更新时间:2025-08-26 点击次数:352
点击次数:352
在人类与癌症的漫长斗争中,手术、化疗和放疗长期占据主导地位。然而,这些传统方法往往伴随着巨大的副作用,且对晚期或转移性癌症的效果有限。直到21世纪初,免疫治疗的出现改变了这一局面,而程序性死亡受体1(Programmed Cell Death Protein 1, PD-1) 作为免疫检查点的关键分子,一跃成为癌症治疗领域的明星靶点。PD-1抑制剂的成功不仅为无数患者带来了新生,还开创了“免疫检查点阻断"这一全新治疗范式。本文将从PD-1的生物学功能、作用机制、临床应用、当前挑战及未来方向等方面,全面探讨这一革命性靶点如何重塑现代癌症治疗格局。
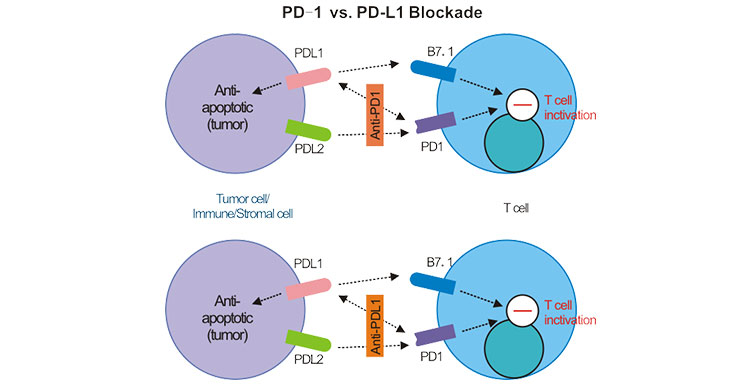
PD-1是一种主要表达于活化T细胞、B细胞和自然杀伤(NK)细胞表面的免疫检查点蛋白,属于CD28超家族成员。其名称“程序性死亡受体"可能容易让人误解,因为它并非直接导致细胞死亡,而是通过传递抑制性信号,调节免疫反应的强度和持续时间,防止过度免疫激活导致的自身免疫损伤。换句话说,PD-1是免疫系统的一种“刹车"机制,确保免疫反应在清除病原体或异常细胞的同时,不伤害正常组织。
PD-1的功能主要通过与其配体PD-L1(Programmed Death-Ligand 1)和PD-L2的结合来实现。正常情况下,当T细胞被激活并攻击外来病原或癌细胞时,PD-1的表达会上调。一旦PD-1与PD-L1/PD-L2结合,便会启动下游信号通路,抑制T细胞的增殖、细胞因子产生和杀伤功能,从而避免免疫反应失控。然而,许多狡猾的癌细胞利用了这一机制:它们通过高表达PD-L1,主动与T细胞表面的PD-1结合,从而“欺骗"免疫系统,逃避免疫监视和攻击。这种肿瘤微环境中的免疫逃逸是癌症发生和发展的重要机制之一。
基于这一原理,科学家开发了PD-1抑制剂(如帕博利珠单抗、纳武利尤单抗)和PD-L1抑制剂(如阿特珠单抗)。这些药物通过阻断PD-1与PD-L1的结合,解除肿瘤对免疫细胞的抑制,重新激活T细胞对癌细胞的杀伤能力。这种策略被称为“免疫检查点阻断",其核心思想是释放免疫系统的天然抗癌潜力,而非直接攻击肿瘤细胞。
自2014年PD-1抑制剂纳武利尤单抗(Opdivo)和帕博利珠单抗(Keytruda)获批以来,免疫检查点抑制剂已改变了多种癌症的治疗标准。截至目前,PD-1/PD-L1抑制剂已在全球获批用于治疗超过20种癌症类型,包括黑色素瘤、非小细胞肺癌、肝癌、胃癌、肾癌、霍奇金淋巴瘤等。此外,这些药物在某些具有特定生物标志物(如微卫星不稳定性高/MSI-H或肿瘤突变负荷高/TMB-H)的实体瘤中表现出显著疗效,成为“不限癌种"治疗的重要突破。
在临床应用中,PD-1抑制剂的使用通常需要考虑多个因素:
癌症类型和分期:例如,在晚期黑色素瘤和非小细胞肺癌中,PD-1抑制剂已成为一线或二线标准治疗选项,显著延长了患者的总生存期。
生物标志物检测:PD-L1表达水平、MSI状态和TMB是预测疗效的重要指标。例如,帕博利珠单抗在PD-L1高表达的非小细胞肺癌患者中疗效尤为显著。
联合治疗策略:为了进一步提高响应率,PD-1抑制剂常与化疗、靶向治疗、放疗或其他免疫治疗(如CTLA-4抑制剂)联合使用。例如,“化疗+免疫"组合在肺癌和三阴性乳腺癌中显示出协同增效作用。
尽管PD-1抑制剂取得了巨大成功,但并非所有患者都能从中受益。总体而言,仅约20%-30%的患者对单药治疗有持续响应,其余患者可能出现原发性或继发性耐药。因此,如何精准筛选优势人群、优化治疗策略仍是当前研究的重点。
尽管PD-1抑制剂为代表的免疫治疗带来了革命性进步,但其临床应用仍面临两大核心挑战:耐药性和免疫相关不良事件(irAEs)。
耐药性问题是限制PD-1抑制剂疗效的主要障碍。耐药机制复杂多样,包括:
肿瘤内在因素:如IFN-γ信号通路突变、抗原呈递机制缺陷(如B2M基因突变)、或替代免疫检查点(如TIM-3、LAG-3)的上调。
肿瘤微环境因素:如调节性T细胞(Tregs)、髓源性抑制细胞(MDSCs)等免疫抑制细胞的浸润,或细胞外基质形成的物理屏障。
宿主因素:如肠道微生物组组成影响免疫治疗响应,某些菌群(如Akkermansia muciniphila)可能增强疗效。
为了克服耐药,研究人员正在探索多种策略:
联合治疗:如PD-1抑制剂与CTLA-4抑制剂、VEGF抑制剂或PARP抑制剂联用。
新型免疫调节剂:针对TIM-3、LAG-3、TIGIT等新兴检查点的抑制剂正在临床试验中。
个性化疫苗和细胞治疗:如基于肿瘤新抗原的疫苗或T细胞受体工程化T细胞(TCR-T)疗法。
免疫相关不良事件(irAEs) 是另一重大挑战。由于PD-1抑制剂激活的免疫反应可能攻击正常组织,导致诸如皮炎、结肠炎、肺炎、肝炎甚至内分泌疾病等副作用。大多数irAEs为轻度至中度,可通过糖皮质激素等免疫抑制剂控制,但严重时可能危及生命。因此,临床管理需密切监测、早期诊断和及时干预。此外,研究发现irAEs的发生可能与疗效正相关,提示免疫激活的双面性。
PD-1研究的未来方向主要集中在个性化医疗、新型药物开发和机制深入探索三个方面。
首先,生物标志物驱动的个性化治疗将是重点。除了现有的PD-L1、MSI和TMB,研究人员正在寻找更精准的预测指标,如血液中的循环肿瘤DNA(ctDNA)动态变化、T细胞受体(TCR)克隆多样性、以及肿瘤免疫微环境的时空异质性。人工智能和多组学技术的结合有望实现更精准的患者分层和疗效预测。
其次,下一代免疫检查点抑制剂正在蓬勃发展。除了针对多个检查点的双特异性抗体(如PD-1/CTLA-4双抗)外,新型药物形式如小分子抑制剂、细胞因子融合蛋白、以及靶向免疫代谢通路(如IDO、腺苷)的药物也在研发中。这些药物可能改善耐药问题并扩大受益人群。
第三,联合策略的优化将是临床转化的关键。例如,放疗与PD-1抑制剂的联合可通过“远隔效应"激活全身免疫反应;溶瘤病毒可通过裂解肿瘤细胞释放抗原,增强免疫细胞浸润;表观遗传药物(如HDAC抑制剂)可逆转肿瘤免疫抑制微环境。
最后,基础研究的深化将揭示PD-1信号通路的全新层面。例如,近期研究发现PD-1不仅表达于T细胞,还存在于耗竭性NK细胞、甚至某些肿瘤细胞上,提示其功能可能比已知的更为复杂。此外,肠道微生物组调控免疫治疗响应的机制正成为热门领域,菌群移植(FMT)或益生菌干预可能成为辅助治疗新策略。
程序性死亡受体1(PD-1)的发现和靶向药物的开发,无疑是癌症治疗的一座里程碑。它不仅为晚期患者提供了长期生存的可能,更推动了免疫学、肿瘤学和药物研发领域的跨越式发展。然而,PD-1抑制剂并非万能神药,其耐药性、毒性和响应率限制仍是亟待解决的难题。未来,通过多学科合作、技术创新和精准医疗的深入推进,我们有理由相信,PD-1研究将继续带着癌症免疫治疗走向更高效、更安全、更个性化的新时代。正如诺贝尔生理学或医学奖得主本庶佑所言:“免疫治疗的故事才刚刚开始",而PD-1无疑是这一故事中精彩的篇章之一。
杭州斯达特 志在为全球生命科学行业提供优质的抗体、蛋白、试剂盒等产品及研发服务。依托多个开发平台:重组兔单抗、重组鼠单抗、快速鼠单抗、重组蛋白开发平台(E.coli,CHO,HEK293,InsectCells),已正式通过欧盟98/79/EC认证、ISO9001认证、ISO13485。
程序性死亡受体1(PD-1):癌症免疫治疗的革命性靶点